【Nat.Chem.】阿尔兹海默症重大突破,从20种设计到3种原子构象,误差仅1.49埃,科学家成功“看见”并制造出tau蛋白病的“迷你坏种子”
今天介绍的这篇文章主要是一项在神经退行性疾病研究领域取得的重大突破。科学家们成功设计并合成了一种微型的人工肽(可理解为小蛋白质片段),它能精确模仿在多种脑部疾病中发现的“致病性”tau蛋白的结构和功能。
这项研究的核心在于,它为我们提供了一种前所未有的工具,来深入理解阿尔兹海默病等“tau蛋白病”是如何发生和发展的,并为开发新的诊断和治疗方法开辟了道路。
下面,我将用更通俗易懂的语言,分层次地为您详细解读这篇重要的科研论文。
第一部分:问题的根源——“变坏”的tau蛋白
1. Tau蛋白:大脑中的“铁路枕木”
在健康的大脑中,有一个叫做“tau”的蛋白质。它的主要工作之一是稳定神经元(也就是脑细胞)内部的微管。微管就像是神经元内部的“铁路轨道”,负责运输各种重要的营养物质和信号分子。因此,正常的tau蛋白对于维持神经元的健康和功能至关重要,就像枕木对于维持铁路的稳定必不可少一样。
2. “变坏”与“传染”:tau蛋白病的元凶
在某些情况下,比如基因突变或异常的化学修饰,tau蛋白会发生错误折叠,从原本可溶的正常状态,变成不可溶的、具有粘性的异常状态。这些“变坏”的tau蛋白会聚集在一起,形成一种叫做“神经纤维缠结”的团块,最终导致神经元死亡。这类由异常tau蛋白聚集引起的疾病,被统称为“tau蛋白病”(Tauopathies),其中最著名的就是阿尔兹海默病。
更可怕的是,这些“变坏”的tau蛋白具有类似“朊病毒”的传播特性。一个错误的tau蛋白团块,可以像一个“坏种子”一样,诱导周围正常的tau蛋白也发生错误折叠和聚集,形成更多的“坏种子”。这些“坏种子”还可以在神经元之间扩散,导致病变在大脑中像瘟疫一样蔓延开来。这种“播种-扩散”的过程与患者认知能力的下降密切相关。
3. 一个棘手的谜题:千变万化的“坏种子”
近年来的尖端研究(冷冻电子显微镜技术,cryo-EM)发现了一个更加复杂的情况:不同类型的tau蛋白病,其大脑中tau蛋白聚集体的三维结构(或称为“折叠方式”)是不同的。例如,在阿尔兹海默病、进行性核上性麻痹(PSP)、皮质基底节变性(CBD)等不同疾病中,tau蛋白缠结的核心结构都各具特色。
这就带来了一个巨大的挑战:我们不清楚究竟是哪种特定的结构决定了其“播种”能力的强弱和疾病的特异性。而且,由于从患者大脑中能获取的tau蛋白样本极为稀少、结构多样且不稳定,我们很难在实验室里稳定地重现这些致病的结构,这极大地阻碍了相关药物的筛选和新型疗法的开发。
因此,科学家们迫切需要找到一种方法,能够在实验室里“制造”出这些结构明确、功能稳定的“坏种子”模型,从而揭开tau蛋白病的秘密。
第二部分:创新的策略——打造“迷你tau”
面对这一难题,该研究团队提出了一种极具创造性的解决方案:不再试图制造整个庞大而复杂的tau蛋白缠结,而是去设计和合成能够模仿其核心功能区域的“迷你版本”。
1. 灵感来源:从致病结构中寻找蓝图
研究人员首先仔细分析了已知的、从不同tau蛋白病患者大脑中提取的tau蛋白缠结的原子级别三维结构。他们发现,在这些复杂的缠结核心,存在着一些被称为“β-弓形(β-arch)”的关键结构模块。这些模块就像是构成整个缠结的“乐高积木”,它们被认为是驱动整个蛋白聚集和“播种”的关键。研究人员特别注意到,在这些β-弓形结构中,除了疏水作用力外,还存在一些特定的、由蛋白质侧链之间形成的极性相互作用(氢键),他们推测这些相互作用对于稳定其致病构象至关重要。
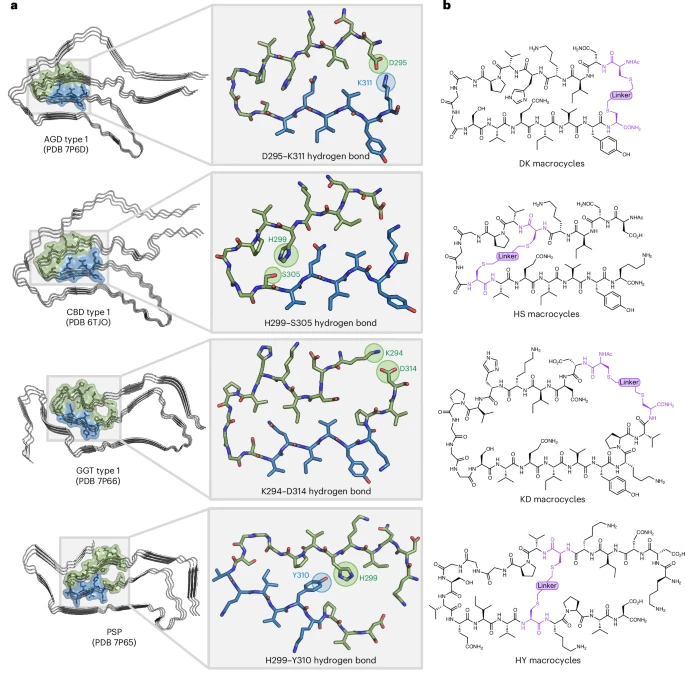
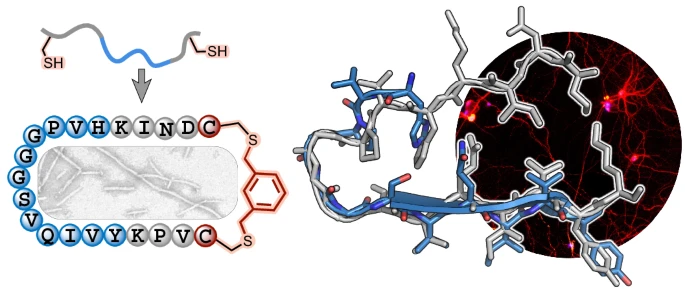
2. 核心技术:化学“订书机”——肽大环化
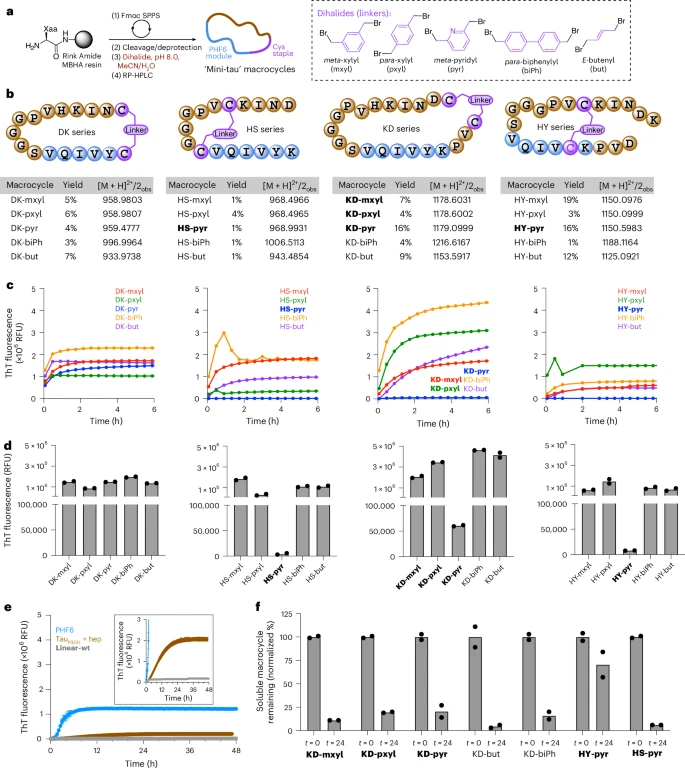
有了设计蓝图,接下来的问题是如何让一小段短肽(蛋白质的小片段)稳定地折叠成预想中的β-弓形结构。研究团队采用了一种名为“肽大环化(peptide macrocyclization)”或“肽钉合(peptide stapling)”的化学策略。
这个过程可以通俗地理解为:
选取片段:他们根据不同疾病(如AGD、CBD、GGT、PSP等)中tau蛋白核心的氨基酸序列,合成了对应的短肽链。
安插“铆钉”:在短肽链的两端,他们将原本形成关键极性相互作用的两个氨基酸替换为半胱氨酸(Cys)。半胱氨酸就像是预先安装好的“铆钉”。
连接“锁扣”:然后,他们使用一种具有两个反应活性的“连接子”(linker)分子,与这两个“铆钉”(半胱氨酸)发生化学反应,从而将短肽链的两端牢牢地“钉”在一起,形成一个稳定的环状结构(即大环肽)。
通过使用不同长度和几何形状的“连接子”,他们可以对这个环的形状进行微调,从而系统性地探索哪种构象最具有致病活性。他们将这些人工合成的、被“钉住”的环状小分子称为“迷你tau”(mini-tau)。
第三部分:惊人的发现——“迷你tau”成功模仿“坏种子”
研究团队合成了一系列共20种不同的“迷你tau”大环肽,并对它们进行了系统性的测试。
1. 自发聚集:“迷你tau”初显身手
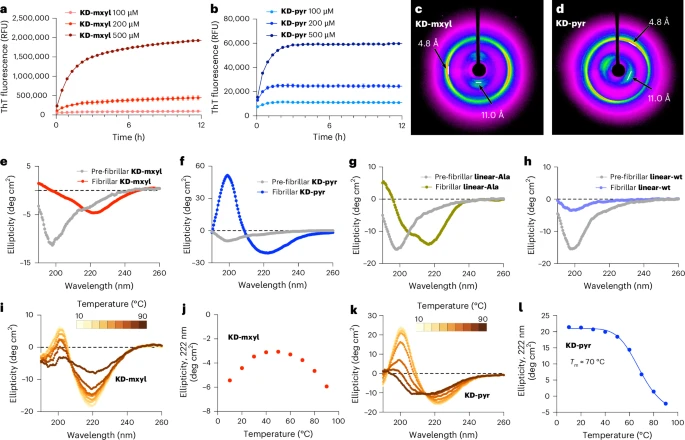
首先,他们发现大部分合成的“迷你tau”分子在溶液中能够自发地聚集起来,形成类似天然淀粉样蛋白的纤维状聚集体。这一点通过硫黄素T(ThT)荧光实验得到了证实,这是一种检测淀粉样蛋白聚集的常用方法。这表明,通过大环化策略,这些短肽确实被赋予了形成β-折叠结构并自我组装的倾向。
2. 关键验证:“迷你tau”的播种能力
接下来是最关键的一步:测试这些“迷你tau”是否具有“播种”能力。他们使用了一种经过基因工程改造的细胞系,这种细胞能够产生一种特殊的tau蛋白,当它被“坏种子”诱导聚集时,会发出荧光。
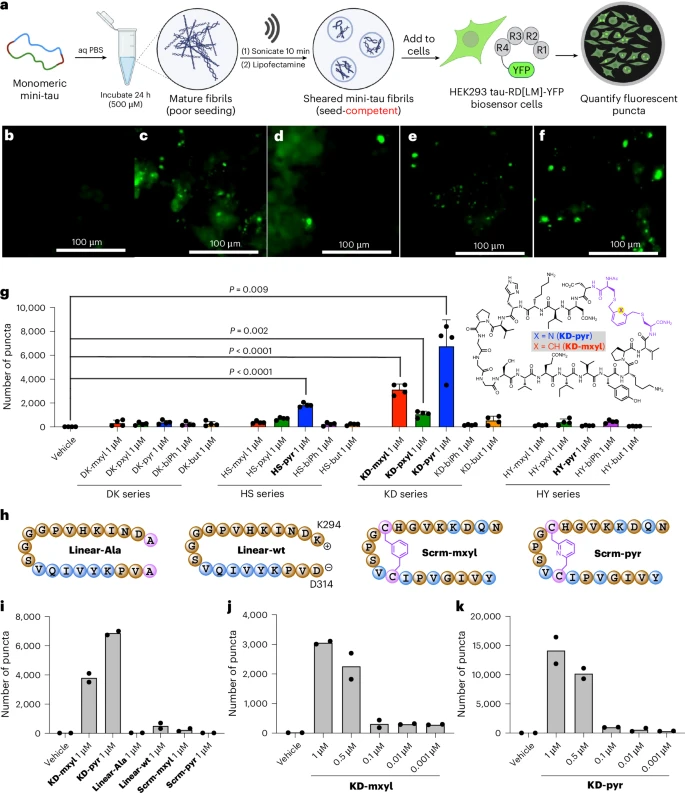
实验结果令人振奋:
成功播种:在20种“迷你tau”中,有几种表现出了明确的播种活性,特别是名为KD-mxyl和KD-pyr的两种分子,效果最为显著和稳定。当将这两种分子的聚集体加入到工程细胞中后,可以清晰地观察到细胞内出现了大量的荧光亮点,表明它们成功地诱导了细胞内源性tau蛋白的聚集。
结构的重要性:为了证明这种播种能力确实来自于其特定的环状结构和序列,研究人员设计了几个对照组:
线性对照:将效果最好的KD-pyr的环状结构打开,变成线性的肽链。结果发现其播种能力大幅下降。
序列打乱对照:保持环状结构和化学成分不变,但将核心的氨基酸序列打乱。结果发现其播种能力也几乎完全丧失。
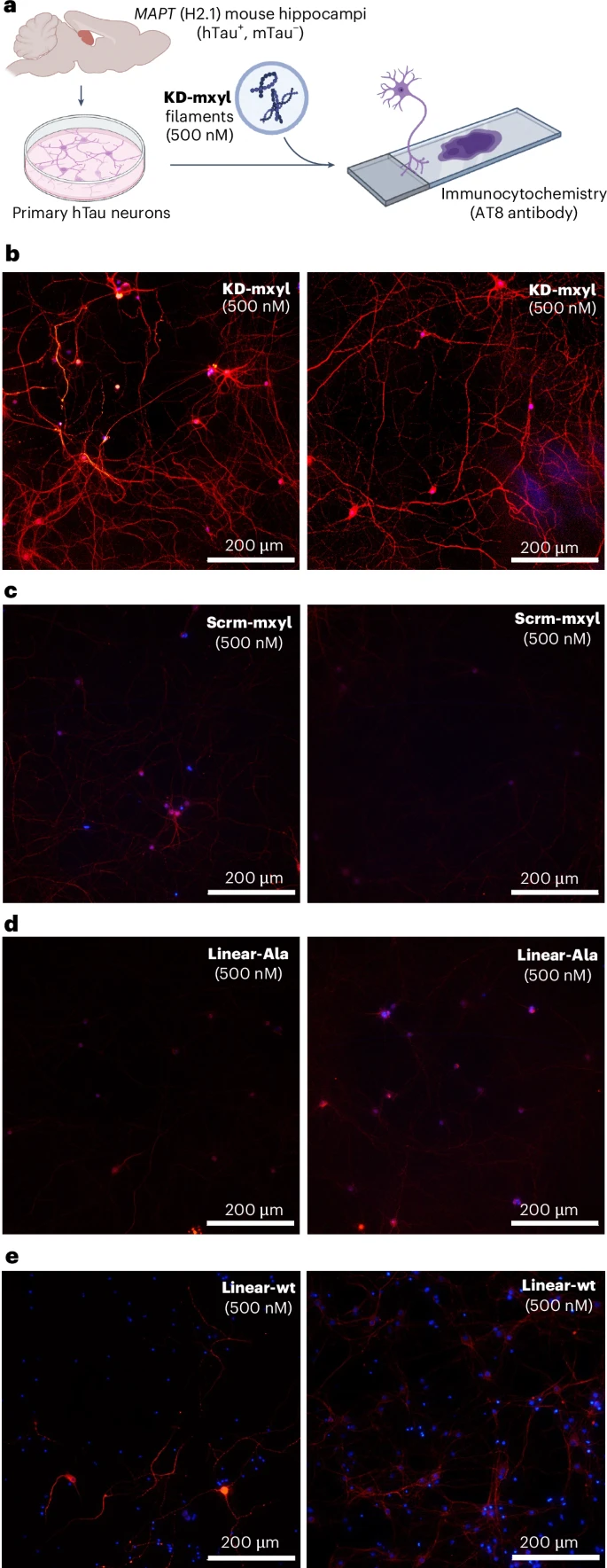
在真实神经元中验证:更具说服力的是,研究团队将最成功的“迷你tau”——KD-mxyl——加入到从表达人类野生型tau蛋白的小鼠身上分离出的原代神经元中。结果发现,KD-mxyl能够有效地诱导这些真实神经元中的人类tau蛋白发生聚集,而对照组的线性肽或序列打乱肽则没有这个效果。
这些实验无可辩驳地证明,他们通过化学合成的方法,成功创造出了具有生物活性的、能够模仿tau蛋白病理核心功能的“迷你坏种子”。
第四部分:眼见为实——揭示“迷你tau”的原子结构
为了彻底搞清楚为什么KD-mxyl具有如此强大的播种能力,研究团队利用**冷冻电子显微镜(cryo-EM)**技术,解析了KD-mxyl聚集形成纤维的原子级别三维结构。
他们得到了一个里程碑式的发现:
KD-mxyl纤维的β-弓形核心结构,与从AGD和CBD这两种真实tau蛋白病患者大脑中提取的tau蛋白缠结的核心结构,表现出惊人的一致性!
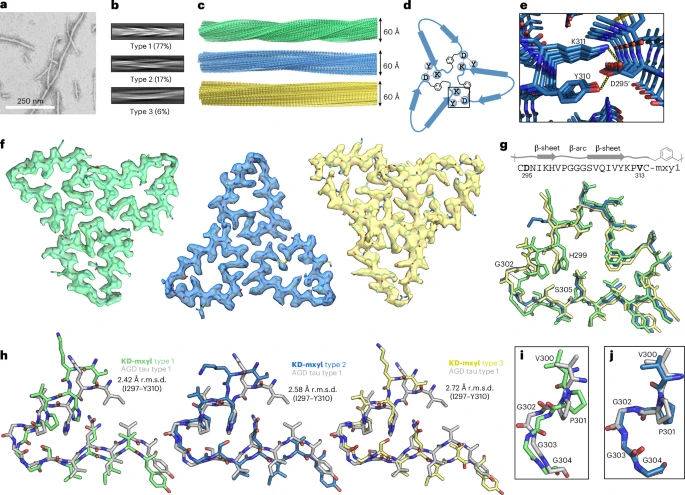
尽管KD-mxyl的设计初衷是模仿GGT病的tau蛋白折叠 ,但其柔性的化学连接子使得它能够“自由探索”并最终稳定在与AGD/CBD病理结构极为相似的构象上。这就像是照着A图纸造零件,结果造出的零件却和B图纸上的完美匹配。
这一发现具有双重意义:
验证了设计的成功:它雄辩地证明了“迷你tau”策略的可行性,确实能够精确复刻出与疾病相关的tau蛋白构象。
揭示了新的机制:它也表明,即使是微小的、通过化学手段施加的结构约束,也足以引导短肽片段折叠成高度复杂的、具有致病活性的特定三维结构。
第五部分:意义与展望——开启tau蛋白病研究的新纪元
这项研究的意义是深远且多方面的:
提供了宝贵的研究工具:科学家们现在有了一种可靠的方法,可以在实验室里大量、稳定地制备出模仿特定疾病tau蛋白构象的“迷你种子”。这为研究tau蛋白的错误折叠机制、 prion样传播过程以及不同构象与疾病类型的关系提供了前所未有的强大工具。
加速药物和诊断方法的开发:这些结构明确的“迷你tau”是理想的靶点。
疫苗开发:可以用它们作为抗原,来开发能够特异性识别并清除某种特定致病构象的治疗性疫苗。
抗体药物:可以筛选和制备出只针对某种病理构象而不影响正常tau蛋白的“构象特异性”抗体,从而实现精准治疗。
早期诊断:也可以利用它们开发新的PET显像剂或生物标志物,用于疾病的早期诊断和分型。
拓展了研究思路:这种“基于结构设计、通过多样性导向的化学钉合来最小化功能表位”的策略,不仅适用于tau蛋白,也可能被应用于其他与神经退行性疾病相关的淀粉样蛋白,如亨廷顿病中的亨廷顿蛋白、帕金森病中的α-突触核蛋白等。
总而言之,这项工作巧妙地结合了结构生物学、化学生物学和神经科学,不仅解决了tau蛋白病研究中的一个长期瓶颈,更提供了一个强大的技术平台,有望在未来彻底改变我们对这类毁灭性脑部疾病的认知、诊断和治疗方式。
参考文献
Angera, I.J., Xu, X., Rajewski, B.H. et al. Macrocyclic β-arch peptides that mimic the structure and function of disease-associated tau folds. Nat. Chem. 17, 865–874 (2025). https://doi.org/10.1038/s41557-025-01805-z